 |
| Fuente:https://www.google.com/url?sa=i&url=https%3A%2F%2Fwww.alimente.elconfidencial.com%2Fnutricion%2F2020-04-19%2Fproteinas-vegetales-perdida-peso_1740022%2F&psig=AOvVaw0mkCA6GN_xsyY5Rpj9n_Q8&ust=1592432883775000&source=images&cd=vfe&ved=0CAMQjB1qFwoTCPijl4Cxh-oCFQAAAAAdAAAAABAD |
LAS PROTEINAS
son macronutrientes esenciales para nuestro desarrollo y
correcto funcionamiento de nuestro cuerpo humano, dentro de la nutrición la
calidad de la proteína esta determinada por el perfil y cantidades de aminoácidos
de las cuales están estructuradas, las proteínas forman parte principal de
forma estructural y funcional de las células así como que llegan a desempeñar
funciones esenciales dentro de nuestro cuerpo(1)
 |
| Fuente:https://as.com/deporteyvida/imagenes/2017/06/26/portada/1498473439_004023_1498473691_noticia_normal.jpg |
Estructura química de aminoácidos
Los α-aminoácidos
son las unidades estructurales principales
de las proteínas , su estructura se basa en ser constituidos de un átomo de
carbono α-covalente
unido a un átomo de hidrogeno y presentar grupo amino y un grupo carboxílico en
su estructura además de una cadena
lateral o grupo R, el grupo amino que se encarga de darle un carácter básico y
el grupo carboxilo se encarga de presentar un carácter acido, las proteínas
naturales suelen contener hasta 20 diferentes
aminoácidos primarios, unidos mediante enlaces amida.(2)
Debido a que a los aminoácidos presentan un carácter acido-básico
estos serán susceptibles a la ionización, por lo tanto, son capaces de perder o
ganar electrones, si su grupo carboxilo (COOH)perdió un hidrogeno de forma que quede
(COO-) tiene un carácter aniónico, pero si el grupo amino agana electrón
de hidrogeno se convierte en catión quedando (NH3+) los aminoácidos
cuentan también con la capacidad que dependiendo de su pH este puede formar grupos
aniónicos o catiónicos mediante pH ácidos
estos ganaran electrones y a pH básicos perderán electrones estos a su vez
pueden regresar a un estado neutral ,además cuando cuentan con una carga
equilibrada o neutral se le denomina zwitterion.
 |
| Fuente:http://www.ehu.eus/biomoleculas/buffers/buffer3.htm |
Dentro del código genético se han encontrado 20 aminoácidos codificables
una parte de todos estos aminoácidos pues ser sintetizado por el ser humano
mientras que aquellos que no son suministrados mediante el consumo de
alimentos, aquellos aminoácidos que entran en la categoría de esenciales son la
Val, Leu, Ile, Phe, Trp, Thr, Met y Lys
Establecido ya los 20 tipos de aminoácidos cabe resaltar que
químicamente hablando estos no presentan una estructura lineal como se presenta
comúnmente en estructuras químicas sino una estructura tridimensional que es la
que se encarga de darle propiedades estructuradas.
 |
| Fuente:https://www.google.com/url?sa=i&url=http%3A%2F%2Fbioquimicafarmacia2016.blogspot.com%2F2016%2F04%2Faminoacidos.html&psig=AOvVaw0rH4NCYg0V8X2Dgbgq7WcP&ust=1592432689756000&source=images&cd=vfe&ved=0CAMQjB1qFwoTCJiB65iwh-oCFQAAAAAdAAAAABAD |
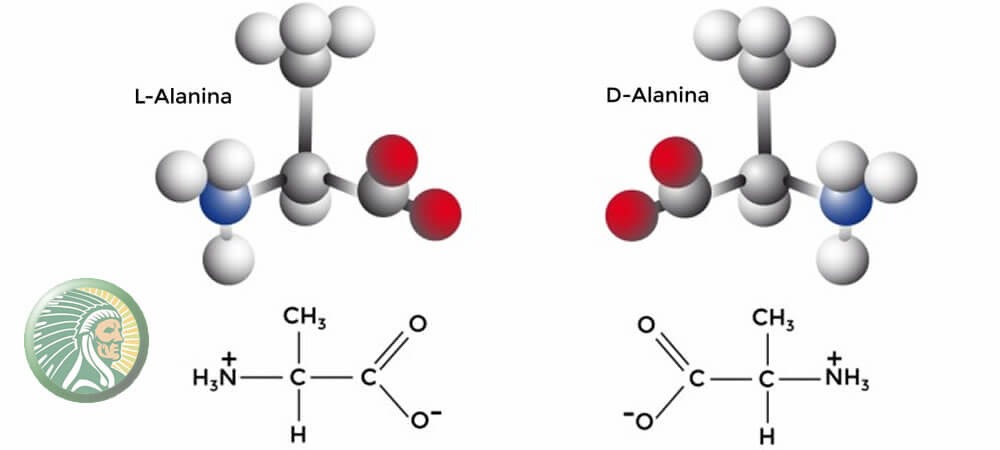
De manera nutricional se distinguen dos tipos de aminoácidos
los Estereoisómeros tambien llamados imágenes especulares como los son la
L-Alanina y D-Alanina, los L-aminoácidos cumplen con procesos bioquímicos no esencial
dentro de la estructura de la naturaleza sin embargo los D-aminoácidos aportan
una funcionalidad biológica aportando significativamente tanto a nivel nutricional
como a biológico.
 |
| Fuente:https://www.weed-growayurveda.com/es/blog/noticias-y-consejos-cultivo-hidroponico-interiores-y-exteriores/cuales-son-los-mejores-aminoacidos
|
Péptidos
Antes de pasar a como se forman las proteínas primero
debemos saber que son los péptidos, los péptidos son cadenas lineales de varios
aminoácidos unidos mediante enlaces químicos de tipo amídico a los que se
denomina Enlace Peptídico. De esta forma que para formar péptidos los
aminoácidos deben de unirse entre sí formando cadenas largas y de secuencias
variable.
Generalmente los péptidos están formados por 50 aminoácidos
si el número de péptidos es menor de 10 se los denomina oligopéptidos de los
cuales dependiendo del número de aminoácidos de 2,3, etc. se conocen como
Di-Tri-Tetrapéptidos, si estos cuentan con más de 10 aminoácidos se denominan
Polipéptidos
¿Como se forman las proteínas a partir de lo aminoácidos?
Una vez que sabemos cómo se clasifican los aminoácidos,
debemos saber cómo se forman las proteínas, las proteínas se forman químicamente
mediante la unión de enlaces covalentes entre los enlaces carboxilo (COO-) y
amida (NH3+) ambos terminales se atraen debido a sus cargas electrónicas
diferentes, entonces de la unión que surgirá como ya mencionamos antes serán enlaces
peptídicos
 |
| Fuente:https://www.slideshare.net/tatianacontreras22/quimica-protenas |
Tambien hay que mencionar que las proteínas presentan cuatro
tipos de estructuración primarias, secundarias, terciarias y cuaternarias, en
la primera es el enlace es simple covalente y peptidico, cuando nos enfocamos
en las estructuras secundarias están representadas por una cadena en espiral de
forma tridimensional, generando un plegamiento de la cadena polipeptídica para
que esto se debe de fuerzas electroestáticas de estos compuestos que generan atracción
entre ellos mediante puentes de hidrógenos y polo-dipolo, la fuerza de atracción
ocasiona que el plegamiento se incremente y genere una forma de la proteína en
ovillos o dominios, esta estará formada por cadenas polipeptídicas que se unen entre sí por fuerzas electro estáticas
su plegamiento se da igual a la secundaria, la estructura cuaternaria de las proteínas
suele ser inestable en este se juntan
varios ovillos de estructura terciaria su cadena poli péptica está unida
mediante fuerza de Van Der Waals que son inestables y suelen regresar a su
estructura terciaria.
Reacciones y Propiedades de las Proteínas
Tambien que los aminoácidos las proteínas tienen sus propias
características cuando se encuentran en medíos ácidos o básicos las propiedades
que presentan son:
Anfótericas
Presentan capacidad de amortiguación que puede actuar como
base o acida dependiendo del pH que se encuentre, permitiéndole resistir
pequeños cambios
Punto Isoeléctrico
El pH de estas proteínas es eléctricamente Neutra, la carga
global que prese3ntan las proteínas es cero lo que genera que su carga isoeléctrica
no las mantenga unidas
Capacidad de retención de agua
el punto isoeléctrico
tiene que ver con su capacidad de retener agua. Cuando las proteínas con muchos
grupos cargados y polares se unen al agua fácilmente, en casos de que ocurra un
cambio en el pH y se activan sus grupos hidrofóbicos esta se separa, cerca de
su punto isoeléctrico tienden a unir menos cantidad de agua produciendo una
afinidad de agua reducida por moléculas de agua
Solubilidad
Algunas proteínas no pueden dispersarse en el agua, pero
estas tienden a dispersarse fácilmente a soluciones salinas diluidas, cambiaran
las fuerzas de atracción de la proteína entonces los grupos cargados en una proteína
unen los cationes aniones de la solución salina con más fuerza que el agua.
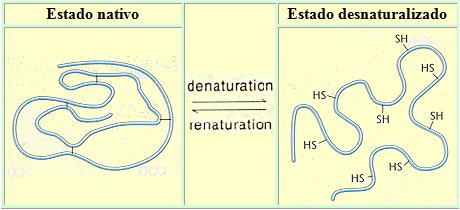
Desnaturalización de la proteína
Cuando la proteína no presentan cambios en su interacción
con el disolvente, se dice que presenta una estructura nativa cuando existe una
perdida en su estructuras superiores en otras palabras secundaria, terciaria o cuaternaria
pero no a la estructura primaria de las proteínas, se le conoce como desnaturalización,
los factores más comunes que ocasionan que afectan a la desnaturalización son
la temperatura, cambio de pH, enzimática y mecánicas evidencian cambios como el
incremento de la viscosidad, precipitación de proteínas, difusión a nivel
nutricional estos cambios ayudan a mejorar la digestibilidad de las proteínas
en nuestro cuerpo.
 |
| Fuente:https://www.google.com/url?sa=i&url=https%3A%2F%2Fsweetprotein.wordpress.com%2Ftag%2Fdesnaturalizacion%2F&psig=AOvVaw0tUeI_0syj3COUVsgWzebN&ust=1592432546567000&source=images&cd=vfe&ved=0CAMQjB1qFwoTCJDLu9avh-oCFQAAAAAdAAAAABAD |
térmica o temperatura:
se pude dar por dos medios de calentamiento o por enfriamiento
en el caso de la cocción de un huevo este al ser cocido con el calor pasará a
coagularse este será un proceso exotérmico y en el caso endotérmico de la gelificación
puede ser la gelatina, al calentar el agua y disolverla luego de enfriarla la proteína
se estabiliza a baja temperatura, generalmente en la industria de alimentos se
aplica como indicador de calidad.
 |
| Fuente:https://www.recetasyconsejos.com/wp-content/uploads/como-cocer-un-huevo.jpg |
Por cambio de pH
Los iones H+ y OH- del agua provocan efectos parecidos, pero
también afectan a la carga eléctrica de los grupos ácidos y básicos de las
cadenas de aminoácidos, estas alteraciones desestabilizan la estructura
primaria y secundaria de las proteínas.
De forma mecánica
formaciones de
emulsiones por forma mecánica ya sea de forma aire-agua, agua y aceite, agua-grasa
ejemplos de estas son la mayonesa, el agua y la grasa al elaborar embutidos
durante el mezclado se genera un proceso de desnaturalización mecánica luego de
someterla a la temperatura finalizara con un nuevo proceso de desnaturalización.
 |
| Fuente:https://fotos01.lne.es/2015/02/27/318x200/2-1.jpg |
Bibliografia:
1.
Augustin Martínez O. Proteínas y péptidos en
nutrición enteral. 2006;1-14. Disponible en: http://scielo.isciii.es/pdf/nh/v21s2/original1.pdf
2.
Damodaran S.
Aminoacidos,peptidos y proteinas [Internet]. 2010. p. 1-30. Disponible en: http://depa.fquim.unam.mx/amyd/archivero/ProteinasI_7448.pd

No hay comentarios:
Publicar un comentario